Dans cet article, nous explorons le principe d'incertitude d'Heisenberg, l'un des concepts fondamentaux de la physique quantique. cet article vise à expliquer ce principe complexe de manière simple et accessible.
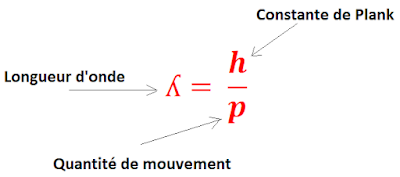
Le principe d’incertitude d’Heisenberg stipule qu’il existe une limite fondamentale à la précision avec laquelle on peut connaître simultanément la position et la quantité de mouvement d’une particule quantique. Plus on mesure avec précision l’une de ces deux grandeurs, moins on peut mesurer avec précision l’autre. Cette limite est donnée par la relation suivante:
Cette relation implique que si on veut localiser une particule quantique avec une grande précision, il faut lui donner une grande quantité de mouvement, et donc réduire sa longueur d’onde. Or, plus la longueur d’onde est petite, plus le caractère ondulatoire de la particule est faible, et plus le caractère corpusculaire est fort. Ainsi, en mesurant la position de la particule, on perturbe son état quantique et on modifie sa nature.
Inversement, si on veut mesurer la quantité de mouvement d’une particule quantique avec une grande précision, il faut lui donner une petite quantité de mouvement, et donc augmenter sa longueur d’onde. Or, plus la longueur d’onde est grande, plus le caractère ondulatoire de la particule est fort, et plus le caractère corpusculaire est faible. Ainsi, en mesurant la quantité de mouvement de la particule, on perturbe son état quantique et on modifie sa nature.
En résumé, le principe d'incertitude d'Heisenberg établit que certaines grandeurs physiques, comme la position et la quantité de mouvement, ne peuvent être mesurées avec une précision absolue en même temps. Cela est dû à la dualité onde-particule des particules quantiques et met en évidence les limites fondamentales de notre connaissance en physique quantique.





0 Commentaires